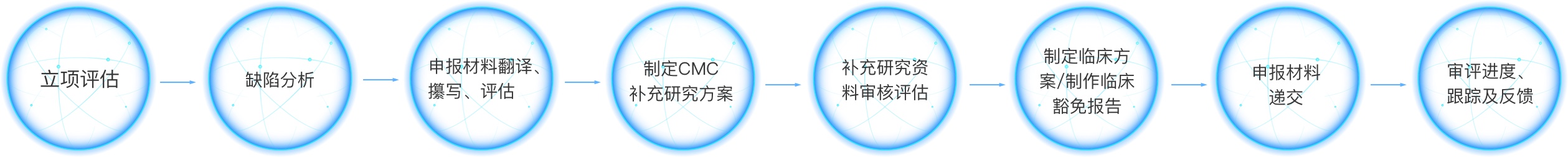
申报材料
药物警戒系统建立情况
审阅方案
审阅研究者手册

临床试验准备阶段
审阅方案、研究者手册
审阅病历报告表及填写指南培训
撰写风险管理计划
配置药物警戒数据库

临床试验进行中
报告收集、处理
SUSAR报告递交
支持一致性核对
支持数据监查委员会
撰写药物研发期间安全性更新报告

临床试验结束阶段
报告收集、处理、递交
审阅临床试验总结报告
起草上市后风险管理计划

药物警戒系统建立情况
审阅方案
审阅研究者手册

审阅方案、研究者手册
审阅病历报告表及填写指南培训
撰写风险管理计划
配置药物警戒数据库

报告收集、处理
SUSAR报告递交
支持一致性核对
支持数据监查委员会
撰写药物研发期间安全性更新报告

报告收集、处理、递交
审阅临床试验总结报告
起草上市后风险管理计划